今回はファインセラミックスの製造プロセスの一つ、合成工程を説明します。
ファインセラミックスの原料の特徴として主に以下があります。
- 微粒子である
- 凝集体がない
- 粒度分布が狭い
- 粒子形状が均一(球状が多い)
- 高純度であること
これらの条件は製品の特性を決定づける因子となるため非常に重要なものになりますが、加えて製造の容易性も必要条件となるため、原料合成は製法の出発点ながら最も重要視された工程となっています。今回は代表的な材料の合成法について解説します。
窒化ケイ素
直接窒化法
金属ケイ素を窒素もしくはアンモニア雰囲気中で加熱する
$$3Si(s)+2N_2(g)\longrightarrow Si_3N_4(s)$$
$$3Si(s)+4NH_3(g)\longrightarrow Si_3N_4(s)+6H_2$$
還元窒化法
シリカと炭素の混合物を窒素もしくはアンモニア中で還元する
$$3SiO_2(s)+6C(s)+2N_2(g)\longrightarrow Si_3N_4(s)+6CO(g)$$
$$3SiO_2(s)+6C(s)+4NH_3(g)\longrightarrow Si_3N_4(s)+6CO(g)+6H_2$$
気相反応法
原料ガスを高温で気相反応させる(特に薄膜製造に利用)
$$3SiCl_4+4NH_3\longrightarrow Si_3N_4+12HCl$$
$$3SiCl_4+6H_2+2N_2\longrightarrow Si_3N_4+12HCl$$
$$3SiH_4+4NH_3\longrightarrow Si_3N_4+12H_2$$
イミド分解法
四塩化ケイ素とアンモニアからシリコンイミドを合成し、熱分解により窒化ケイ素を得る
$$SiCl_4+6NH_3\longrightarrow Si(NH)_2+4NH_4Cl$$
$$Si(NH)_2(s)\longrightarrow Si_3N_4(s)+2NH_3(g)$$
炭化ケイ素
アチソン法(シリカ還元炭化法)
1対の電極間に黒鉛を、その周囲にシリカとコークスの混合粉を置き、通電することで還元炭化させる
$$SiO_2(s)+3C(s)\longrightarrow SiC(s)+2CO(g)$$
炭化法
金属ケイ素、もしくは一酸化ケイ素を炭化する
$$Si(s)+C(s)\longrightarrow SiC(s)$$
$$SiO+2C(s)\longrightarrow SiC(S)+CO(g)$$
気相反応法
ケイ素、炭素の混合ガスを高温で反応させ、炭化ケイ素を気相から粉末として析出させる
$$7SiCl_4+C_7H_8+10H_2\longrightarrow 7SiC+28HCl$$
$$SiH_4+CH_4\longrightarrow SiC+4H_2$$
$$CH_3SiCl_3\longrightarrow SiC+3HCl$$
アルミナ
ファインセラミックスと言えばこれ、というような材料。よく使っている方も多いのではないでしょうか。
バイヤー法
ボーキサイトに混在している酸化鉄、酸化チタン、シリカなどの不純物をアルカリ処理により分離し、析出した水酸化アルミニウムを焼成してアルミナを得る
$$Al_2O_3+2OH^−+3H_2O\longrightarrow 2[Al(OH)_4]^−$$
$$2Al(OH)_3\longrightarrow Al_2O_3+3H_2O$$
アンモニアミョウバン熱分解法
アンモニウムミョウバン$$NH_4Cl(SO_4)_2・12H_2$$の再結晶を繰り返し、最終的に熱分解を行いアルミナを取り出す
ジルコニア
ジルコニウム塩水溶液$$ZrCl_2・8H_2O$$の加水分解法
もしくは、ジルコニウムアルコキシド$$Zr(OC_2H_7)_4$$の加水分解法
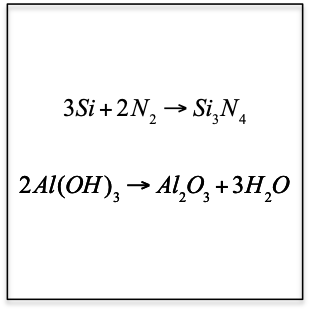



コメント