今回は電池の起電力と電気化学当量について説明します。電池のエネルギーを決める重要な因子の一つに電圧がありますが、それは起電力に応じて変化します。https://konju-ceramic.com/secondary-battery-constitution/にて説明した標準電極電位とネルンストの式から、各種電池の起電力を計算できるようにしましょう。また、表に電極反応と電気化学当量を示しましたので、材料選択や試算に参考にしてみてください。
起電力
正極材料の電極電位と負極材料の電極電位の差が電池の起電力(Electromotive Force)となります。$$起電力=正極電位−負極電位$$電池反応を次のように表記すると$$正極反応 Ox_1+ne^−\longrightarrow Red_2$$$$負極反応 Red_1\longrightarrow Ox_2+ne^−$$となり、全反応は次のように表されます。$$Ox_1+Red_1\longrightarrow Red_2+Ox_2・・・式(1)$$したがって、この電池反応の起電力Eはネルンストの式を用いると次のように表されます。$$E=(_1E^0−_2E^0)+\frac{RT}{nF}ln\frac{a_{Ox1}a_{Red1}}{a_{Ox2}a_{Red2}}・・・式(2)$$
式(2)の反応が右向きに進行したときに変化するGibbsの自由エネルギーをΔGとすると、ΔGと電池の起電力ΔEの間には$$−ΔG=nFE・・・式(3)$$の関係が成立します。Gibbsの自由エネルギーΔGが減少する場合(値が負になる場合)には反応が自発的に右向きに進むことになり、E が正の値となります。すなわち、起電力が得られて電池として働くことになります。Eが負になる場合は外部から電力を与えてE以上の電圧を印加すると反応が右向きに進むことになり、これは電気分解が起こることを意味しています。実際、二次電池を充電する反応は式(1)を逆に書いて$$Red_2+Ox_2\longrightarrow Ox_1+Red_1$$の反応を右向きに進めて電気分解を進行させることになります。
容量と電気化学当量
正極・負極活物質からどれだけの電荷を取り出すことができるかはファラデーの法則に従い、正極・負極反応に関係する電子数と活物質の分子量あるいは原子量によって決まります。1クーロンの電気量を取り出すのに必要な化学物質の量を電気化学当量といいます。二次電池に用いられる酸化剤、還元剤の電気化学当量を表に示します。電気化学当量は主たる起電物質に対してよく示されていますが(今回の表もそうなっています)、正確には関係する化学種すべてを考えるべきです。鉛蓄電池を例に取ると、負極の反応は$$Pb+SO_4^{2−}\longrightarrow PbSO_4+2e^−$$正極の反応は$$PbO_2+H_2SO_4+2H^++2e^−\longrightarrow PbSO_4+2H_2O$$となり、PbとPbO2だけでなく電解液中の2H2SO4も反応に直接関わり、起電物質となっていることがわかります。
実際の電池の容量は、一定の条件で充電された電池を一定の条件で放電して放電終止電圧に達するまでに取り出すことができる電気量で表します。そのため、充電の仕方、放電の仕方により影響を受けます。0.1C以下の小さな電流で一定電圧(充電終止電圧)まで充電し、その後その電圧で充電を続けて一定電流値以下になった時点で充電が終了したとする、定電流定電圧充電(CCCV充電)といわれる方法がリチウムイオン電池には用いられます。放電は一定の電流で放電して一定の電池電圧(放電終止電圧)になったところで放電が終止したとされます。放電電流が大きいと電池の内部抵抗のために電池電圧が低くなり、放電終止電圧に速く達して容量が低くなります。
Cレート放電
充放電の電流値を表すのにCレート(capasity rate)がよく用いられます。これは、電池の容量(生産者が示す定格容量が基準)に対して1時間で放電する電流値のことをいいます。よくクーロンのCと間違われますが、Capacity(容量)のCになりますので間違えないようにしてください。電池が大きくなれば1C放電でも電流値は大きくなります。Cレートの代わりにIt放電と表現することもありますが、意味は同じです。
表 電極反応と電気化学当量
| 電極反応 | 電気化学当量[mg] |
| Li+/Li | 0.0719 |
| Na+/Na | 0.238 |
| Mg2+/Mg | 0.126 |
| Al3+/Al | 0.0932 |
| ZnO22−/Zn | 0.678 |
| H2/OH− | 0.0104 |
| Cd(OH)2/Cd | 0.582 |
| Zn2+/Zn | 0.678 |
| Fe2+/Fe | 0.289 |
| Cr3+/Cr2+ | 0.539 |
| Cd2+/Cd | 0.582 |
| PbSO4/Pb | 1.074 |
| Ni2+/Ni | 0.304 |
| MnO2/MnOOH | 1.325 |
| Cu2+/Cu | 0.329 |
| Ag2O/Ag | 2.401 |
| O2/OH− | 0.0829 |
| NiOOH/(NiOH)2 | 0.950 |
| Fe3+/Fe2+ | 0.589 |
| Ag+/Ag | 1.118 |
| Br2/Br− | 0.828 |
| O2/H2O | 0.0829 |
| Cl2/Cl− | 0.367 |
| Ce4+/Ce3+ | 1.477 |
| PbO2/PbSO4 | 1.239 |
| F2/F− | 0.1969 |
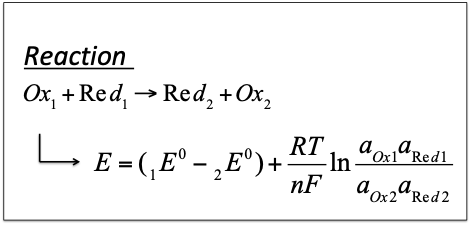



コメント